
Metode Gravimetri dalam Analisis Kimia
Dalam dunia analitik, terdapat bermacam metode kuantitatif untuk menentukan kadar suatu senyawa. Selain metode yang berdasarkan penentuan volume (titrimetri), pengukuran berdasarkan massa juga termasuk analisis kuantitatif. Metode ini merupakan metode gravimetri. Lantas bagaimana sebenarnya prinsip dari gravimetri?
Metode Gravimetri, Apa Maksudnya?
Suatu prosedur pengukuran berdasarkan penentuan massa senyawa murni terhadap analit disebut dengan gravimetri. Metode analisis ini merupakan turunan dari ISO-14242/2: 2000 yang terdiri dari pengukuran pengurangan massa dari komponen analit. Secara umum, terdapat lima jenis analisis gravimetri.
a. Gravimetri presipitasi (precipitation gravimetry)
Pemisahan analit dari larutan sampel sebagai endapan. Analit tersebut dipisahkan melalui pengubahan dirinya menjadi senyawa lain sehingga dapat mengendap dan terpisah. Metode ini yang akan menjadi pembahasan utama kali ini.
b. Gravimetri penguapan (volatilization gravimetry)
Pemisahan analit dengan mengubahnya menjadi gas.
c. Elektrogravimetri
Pemisahanan analit dengan deposisi pada elektroda oleh arus listrik. Penentuan konsentrasi analit selanjutnya dapat melalui massa produk hasil deposisi.
d. Titrimetri atau titrasi gravimetrik (gravimetric titrimetry)
Massa reagen standar bereaksi dengan analit.
e. Termogravimetri
Analisis termal melalui pengukuran perubahan fisik dan kimia dari suatu material terhadap kenaikan suhu ataupun fungsi waktu.
Baca juga: Titrasi Asam Basa: Prinsip dan Aplikasi
Metode Gravimetri Presipitasi
Metode gravimetri ini merupakan yang paling umum. Sesuai namanya, prinsip dari metode ini yaitu mengubah analit menjadi senyawa lain yang dapat mengendap. Setelah proses pengendapan, filtrasi atau penyaringan, bersamaan dengan pencucian, dilakukan untuk memisahkan endapan tersebut dengan larutannya.
Prosedur metode gravimetri
- Pelarutan sampel dengan pelarut yang tepat, misalkan air.
- Penambahan agen presipitasi.
- Pemisahan endapan dari larutan melalui filtrasi dengan kertas saring.
- Penambahan agen presipitasi ke dalam larutan hasil penyaringan untuk memastikan semua analit telah mengendap.
- Proses filtrasi ulang.
- Pencucian endapan dengan air demineralisasi.
- Pengeringan dengan pemanasan kertas saring beserta endapannya yang diletakkan di cawan (yang telah diketahui massanya) ke dalam oven.
- Pencatatan massa cawan beserta sampel yang telah kering. Perolehan massa akhir yaitu massa cawan berisi sampel dikurangi massa cawan kosong.
Contoh aplikasi
Penentuan kadar ion Ca2+ (kalsium) dalam air merupakan salah satu aplikasinya, yang telah menjadi metode resmi oleh Association of Official Analytical Chemists. Metode ini menggunakan asam oksalat (H2C2O4) dan amonia (NH3). Penambahan asam oksalat dan amonia ke dalam larutan sampel akan menghasilkan endapan putih, yang merupakan kalsium oksalat (CaC2O4).
Proses filtrasi berlangsung untuk memisahkan padatan tersebut, lalu mengeringkannya di dalam suatu cawan yang massanya sudah tercatat. Pemanasan kalsium oksalat tersebut akan mengubahnya menjadi spesi CaO. Setelah proses pendinginan pada suhu ruang, Anda dapat melakukan perhitungan kadar analit melalui selisih massa antara cawan berisi analit dengan cawan kosong.
Reaksi yang berlangsung
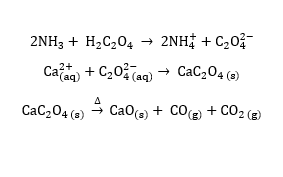
Baca juga: Presisi dan Akurasi dalam Sains, Apa Bedanya?
Reagen untuk proses presipitasi
Reagen yang digunakan untuk mengendapkan (agen presipitasi) harus bersifat spesifik dan selektif ketika bereaksi analit. Spesifik berarti hanya bereaksi dengan spesi tunggal sedangkan selektif berarti bereaksi dengan beberapa spesi tapi terbatas (lebih umum). Agar spesifisitas dan selektivitasnya baik, agen presipitasi yang ideal akan bereaksi dengan analit untuk menghasilkan produk yang:
- Mudah disaring dan dicuci (agar bebas kontaminan)
- Kelarutannya rendah sehingga analit tidak hilang ketika filtrasi dan pencucian
- Tidak reaktif terhadap atmosfer
- Komposisi penyusunnya jelas
Reagen selektif
Contohnya adalah AgNO3 yang dalam suasana asam dapat bereaksi dan membentuk endapan dengan Cl–, Br–, I–, dan SCN–. Misalnya AgNO3 dengan ion Cl– akan menjadi endapan AgCl.
Reagen spesifik
Contohnya adalah dimetilglioksim atau DMG. Senyawa ini hanya akan membentuk endapan jika bereaksi dengan Ni2+ menjadi Ni(DMG)2 dalam suasana basa.
Agen presipitasi anorganik
Berikut adalah beberapa contoh agen presipitasi anorganik beserta unsur yang diendapkannya.
| Agen presipitasi | Unsur yang diendapkan |
| NH3 (aq) | Be (BeO), Al (Al2O3), Sc (Sc2O3), Fe (Fe2O3), In (In2O3) |
| H2S | Zn (ZnO or ZnSO4), Ge (GeO2), Sb (Sb2O3) |
| H2SO4 | Li, Mn, Sr, Cd, Pb, Ba (sebagai sulfat) |
| H2C2O4 | Ca (CaO), Sr (SrO), Th (ThO2) |
| HCl | Ag (AgCl), Hg (Hg2Cl2), Si (SiO2) |
| AgNO3 | Cl (AgCl), Br (AgBr), I(AgI) |
| HNO3 | Sn (SnO2) |
Agen presipitasi organik
Reagen organik untuk presipitasi salah satunya dapat membentuk senyawa koordinasi dengan analit melalui donasi pasangan elektronnya. Contohnya adalah kompleks Ni2+ dengan DMG sebagai berikut.

Pengeringan padatan tersebut pada suhu 110°C akan menghasilkan senyawa dengan komposisi C8H14N4NiO4. Selain DMG, 8-hidroksiquinolin (oksin) juga merupakan agen presipitasi organik yang dapat membentuk endapan dengan ion magnesium.
Sifat endapan untuk metode gravimetri
Endapan untuk metode gravimetri biasanya berukuran besar. Hal ini bertujuan untuk memudahkan saat proses filtrasi atau penyaringan sehingga tidak membutuhkan kertas saring dengan pori berukuran sangat kecil. Endapan juga dapat berwujud kristalin dan ini akan memudahkan Anda untuk memfiltrasi.
Proses pengeringan endapan
Proses pemanasan sampel berlanjut setelah filtrasi selesai hingga massanya konstan. Hal ini bertujuan untuk menghilangkan pelarut dan spesi volatil yang merupakan sisa dari proses presipitasi dan pencucian. Terkadang, pembakaran sampel juga dilakukan untuk dapat mendekomposisi padatan dan membentuk senyawa lain yang komposisinya telah diketahui (seperti contoh analisis kandungan kalsium dalam air).
Aplikasi Metode Gravimetri
Metode gravimetri telah memiliki aplikasi yang cukup luas dalam prosedur analitik. Penentuan kation dan anion anorganik serta spesi netral seperti SO2, CO2, dan I2 merupakan salah satu aplikasinya. Tak hanya itu, aplikasi metode ini telah merambah ke penentuan zat organik.
Contohnya adalah penentuan laktosa dalam produk susu, salisilat dalam preparasi obat-obatan, nikotin dalam pestisida, kolesterol dalam sereal, dan benzaldehida dalam ekstrak almond. Metode gravimetri tidak membutuhkan kalibrasi ataupun standardisasi. Hal ini karena hasil akhirnya merupakan perhitungan langsung dari eksperimen sehingga untuk menganalisis satu atau dua sampel, metode ini dapat menjadi pilihan.
Baca juga: Sebelas Komponen Jaminan Mutu Laboratorium Sesuai ISO 17025:2017
Contoh Perhitungan Penentuan Kadar Kalsium dari Data Gravimetri
Penentuan kadar kalsium dalam 200 mL sampel air dilakukan dengan metode gravimetri melalui pengendapan kalsium menjadi CaC2O4. Massa cawan kosong sebesar 26,6002 gram sedangkan massa cawan beserta CaO (56,077g/mol) adalah 26,7134 gram.
Maka, massa CaO = 26,7134 – 26,6002 = 0,1132 gram.
Jumlah (mol) Ca akan sama dengan jumlah CaO, sesuai persamaan reaksi pada gambar 1, sehingga:
mol Ca = massa CaO / Mr CaO = 0,1132 / 56,077 = 2,0186 x 10-3 mol
Maka, konsentrasi Ca pada sampel (dalam satuan gram/100mL sampel) adalah sebagai berikut.
Konsentrasi Ca = mol Ca x Ar Ca / volume sampel = 0,1132 x 40,078 / 200 = 0,0809 gram/200mL sampel akan setara dengan 0,0405 gram/100mL sampel.
